この記事は、2023年7月に日本口腔外科学会等の顎骨壊死検討委員会から公開された「薬剤関連顎骨壊死の病態と管理:顎骨壊死検討委員会ポジションペーパー2023」に関する内容になります。
ポジションペーパー2023は本文だけでも27ページ(4万文字以上)となっており、本記事ではそれを1/3以下にまとめ、また前回のポジションペーパー2016との変更点についても解説しております。ぜひ皆様の臨床の参考にして頂ければと思います。
顎骨壊死に関連する名称・略語について
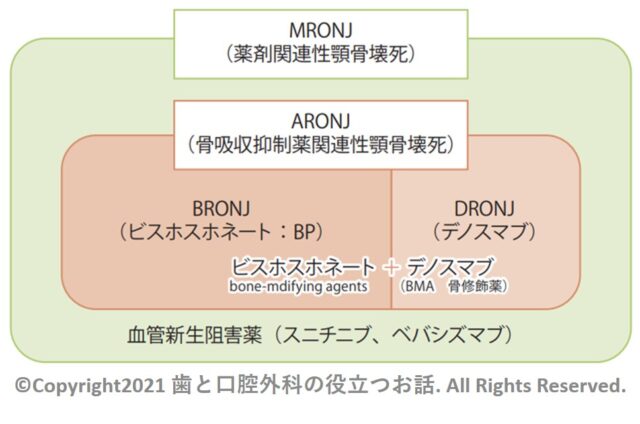
・MRONJ:薬剤関連顎骨壊死(medication-related osteonecrosis of the jaw)
・ARONJ:骨吸収抑制薬関連顎骨壊死(antiresorptive agent-related osteonecrosis of the jaw)
・DRONJ:デノスマブ関連顎骨壊死(denosumab -related osteonecrosis of the jaw)
・BRONJ:ビスホスホネート系薬剤顎骨壊死(bisphosphonate-related osteonecrosis of the jaw)
・ARA:BP製剤とDmab製剤の両者を合わせた骨吸収抑制薬のこと(antiresorptive agent)
・BP製剤:ビスホスホネート系薬剤(bisphosphonate・商品名一覧はこちら)
・Dmab製剤:デノスマブ製剤(denosumab・抗RANKLモノクローナル抗体・ランマーク皮下注やプラリア皮下注)
血管新生阻害薬
・スニチニブ(sunitinib・スニチニブリンゴ酸塩・スーテントカプセル)
・ベバシズマブ(bevacizumab・抗VEGFヒト化モノクローナル抗体・ベバシズマブBS点滴静注)
骨粗鬆症薬の新規薬剤
・ロモソズマブ(romosozumab・ヒト化抗スクレロスチンモノクローナル抗体・イベニティ皮下注)
ポジションペーパー2023の特色と変更点
・BP製剤やDmab製剤、血管新生阻害薬に加えロモソズマブといった新規薬剤によるMRONJも報告されてきたたため、PP 2016では顎骨壊死の呼称はARONJとされていたが、PP 2023では診断名をMRONJとした。
・MRONJの診断において、潜在性・非骨露出型病変であるステージ0は診断基準(骨露出)を満たさないことから、分類としては残したがMRONJではないとした。
・PP 2023では用量別、薬剤別や投与間隔の違い等における本邦での最新のMRONJの発症頻度を調査・記載した。
・MRONJ発症のリスク因子として、抜歯などの手術侵襲よりも顎骨の感染の存在を重視した(特に低用量において)。
・PP 2016ではステージ1は保存的治療、ステージ2はまず保存的治療を施行し、難治例に対して抗菌薬療法および外科的治療を考慮、ステージ3は外科的治療が主な治療法として記載されたが、近年ステージによらず外科的治療が有効であるというエビデンスが集積していることから、PP 2023ではステージ2および3では外科的治療を推奨とした。
・抜歯および歯科インプラント埋入手術以外の侵襲的歯科治療(歯周外科手術、歯根端切除術、骨隆起の除去など)については、十分なエビデンスがなくMRONJ発症との関連は不明である。
・抜歯時の予防的休薬については、「原則として休薬しないことを提案する」とした。
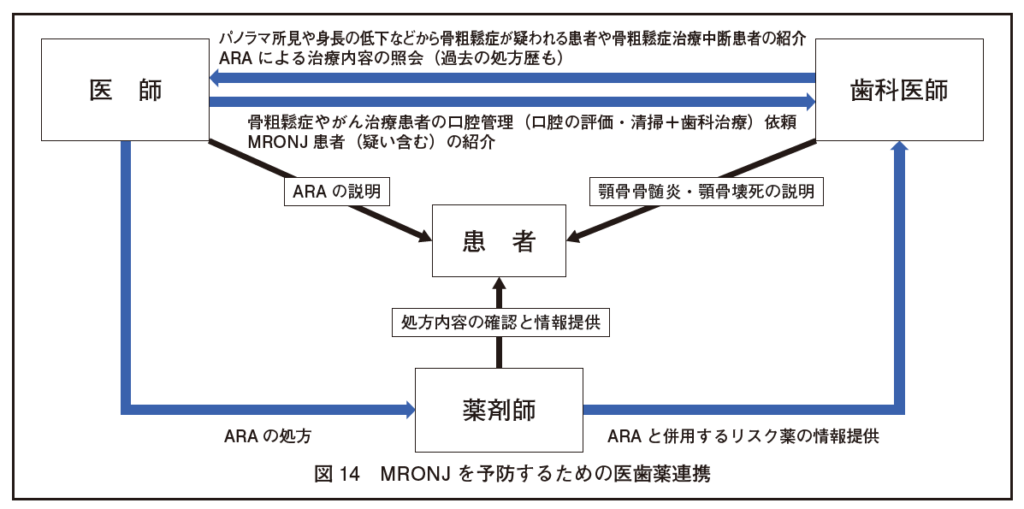
・MRONJの予防に際しては医科歯科連携が重要であることはPP 2016でも明記されてきたが、PP 2023では、連携に不可欠な処方医からの情報および歯科医からの情報を明記し、医歯薬連携の実例を提示した。
MRONJの診断基準
以下の3項目を満たす場合にMRONJと診断する。
①BPやDmab製剤による治療歴がある。
②8週間以上持続して、口腔・顎・顔面領域に骨露出を認める。または口腔内、あるいは口腔外から骨を触知できる瘻孔を8週間以上認める。
③原則として、顎骨への放射線照射歴がない。また顎骨病変が原発性がんや顎骨へのがん転移でない。
【解説】
❶MRONJ の原因薬剤について
PP 2016 では、ARA(BP 製剤とDmab製剤)投薬患者に発症する疾患概念であったが、近年ロモソズマブや血管新生阻害薬であるベバシズマブ、スニチニブ、免疫抑制薬であるメトトレキサート、エベロリムスなど骨吸収抑制薬とは異なる作用機序の薬剤も登場したことから、本委員会では、この疾患の病態を様々な骨修飾薬(BMA)からなる「薬剤に関連する顎骨疾患」という位置づけで、MRONJを採用した。しかし、ARAであるBP製剤とDmab製剤が本疾患の主たる原因である。
❷骨露出を認める期間について
8週間以上骨露出が持続するという解釈は、一般的に抜歯をはじめとする骨露出を伴う歯科的治療後の創の治癒経過を念頭に置いたものである。近年、本疾患の病態に関する多くの報告が蓄積され、歯科的治療前にすでに潜在的に本病変が発症している症例を経験するようになった。しかも骨露出を伴わない症例(いわゆるステージ0)が多く存在することから、8週以内でも、経過や画像所見などから明らかに治癒傾向のない骨壊死がみられる場合はMRONJと診断できることを本委員会で支持するに至った。
❸放射線治療とARA の治療歴が重なった場合の解釈
放射線照射歴があり、BPやDmab製剤も投与されている場合、放射線とARAのいずれに由来するかを判断するのは容易ではないが、照射線量やARAの累積投与量、画像所見から総合的に判断する。
臨床症状とステージング


画像診断について
1. 単純X線検査およびパノラマX 線検査
・ 口内法X線画像は歯根膜腔や歯槽硬線、局所の骨融解・骨硬化の評価に有効な検査法である。
・ パノラマX線画像は下顎管や上顎洞底等の広範囲な評価が可能だが、種々の障害陰影や拡大率の不均一があり、頬舌的情報がCT より劣る。
2. CT
・ CTは骨融解や骨硬化、皮質骨の破壊、腐骨分離、抜歯窩の残存、下顎管の肥厚、上顎洞底線の肥厚、上顎洞炎等を三次元的に評価可能である。
・蜂巣炎や瘻孔形成等の周囲軟組織変化も検出可能である。
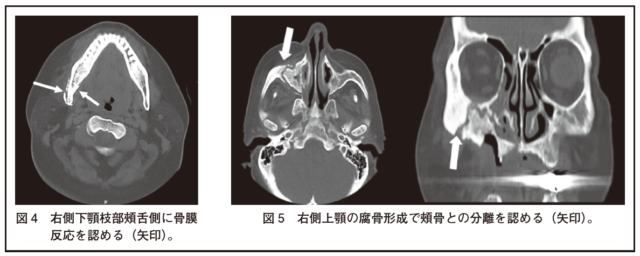
・CTは特に種々の骨変化を顕著に生じるステージ2、3で有用である。骨融解や骨硬化、あるいは骨融解・硬化混合像の他に、腐骨形成・分離や骨膜反応(層状、塊状)が重要な画像所見となる(図4)。
・ステージ3では、頬骨や口蓋骨の骨硬化・骨融解が進み、上顎洞底の骨融解で上顎洞炎は増悪する。下顎骨下縁の骨融解で下顎骨の病的骨折が起こる。上顎の腐骨形成で頬骨の分離が見られることがある(図5)。
3. MRI
・MRIは骨髄の炎症や周囲軟組織の炎症波及範囲の評価に優れる。
・骨髄炎が疑われるがX 線画像で捉えられない場合に特に有用である。
・下顎骨骨髄炎の典型的な臨床症状であるVincent症状を呈する場合でも骨変化が乏しく、単純X 線画像やCTでの診断が困難な場合がある。
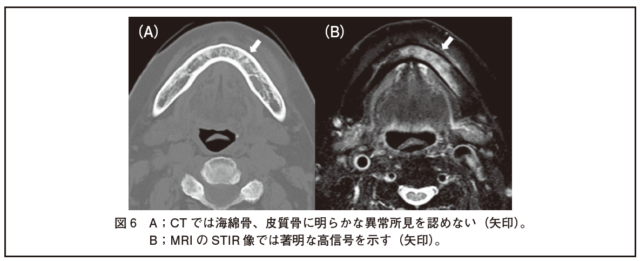
・特に骨髄の炎症評価には脂肪抑制像であるSTIRによる観察が優れている。骨髄に炎症性変化がみられる場合、T1強調像で低信号、T2強調像およびSTIRで高信号となる(図6)。
・骨壊死が存在する場合には、T1強調像、T2強調像で低信号になる。
・MRIでは骨露出のない場合や壊死に至る前の顎骨骨髄炎の段階での評価が可能である。
4. 核医学検査
発症に関わるリスク因子

ARAの投与を受けている患者は、薬剤関連因子や局所因子、全身因子、遺伝的要因が加わるとMRONJの発症リスクが高くなることが報告されている。
薬剤関連因子では、BP製剤では高用量が低用量より発症頻度が高く、Dmab製剤についても同様の傾向が確認されている。また、累積投与量についても高用量と低用量いずれにおいても長期投与に伴いMRONJの発生リスクは増加する。
局所因子では、多くの臨床および基礎的研究において細菌感染とMRONJ発症との因果関係が報告されている。このため、口腔衛生状態の不良や歯周病、根尖病変、顎骨骨髄炎、インプラント周囲炎などの顎骨に発症する感染性疾患は、MRONJの明確なリスク因子であるといえる。一方、抜歯をはじめとする侵襲的歯科治療は、従来からMRONJ発症の最大のイベントとして注視されてきた。しかし抜歯の適応となる重度の歯周病や根尖病変などの歯科疾患の多くは、すでに顎骨に細菌感染を伴っていることが多く、最近では抜歯だけがMRONJ発症の主たる要因ではないといわれている。
非感染性の局所要因として、不適合な義歯や歯周組織を損傷する過大な咬合力、下顎隆起、口蓋隆起、顎舌骨筋線の隆起の存在がある。口腔の特殊性として、口腔粘膜は薄く、外傷などにより容易に骨露出をきたすことが挙げられる。解剖学的要因として、下顎が上顎よりも発症頻度が高いことが挙げられる。
全身因子として、糖尿病や自己免疫疾患、人工透析中の患者は、疾患のコントロール状態や投与薬剤、感染に対する抵抗性の低下などにより、MRONJの発症リスクが増加する。
発症メカニズム
・骨のリモデリング阻害
MRONJ発症の最も中心的な発症メカニズムであると考えられる。
BP製剤やDmab製剤は、生体内で直接的あるいは間接的に破骨細胞の活性化を阻害することにより骨密度を増加させる。これにより骨のリモデリングが抑制され、新しい骨に置き換わることなく骨細胞の寿命を迎え、壊死に陥りやがてMRONJが発症する。
・細菌感染
多くの動物実験で、顎骨に炎症または感染を伴うとヒトの病態に近いMRONJが発症すると報告している。
・血管新生阻害
ゾレドロン酸をはじめとするBPは、多くの実験系で血管新生を直接阻害することが報告されている。
動物モデルでは、BP投与により抜歯窩の治癒過程の初期において新生血管が阻害され、微小血管数の減少を認めた。また、BPは骨芽細胞が産生する血管内皮細胞増殖因子(VEGF)を直接阻害し、骨形成および血管新生を抑制することにより抜歯窩の治癒を遅延することが確認された。
MRONJの進展経路
多くの基礎研究や臨床報告の結果から、MRONJの進展経路については大きく2つの視点でとらえる必要があると考えられる。
1つは、ARAが口腔内の感染病変の病態を修飾して骨髄炎を誘発する、すなわち感染病巣内でARAが引き金となってMRONJを生じるものである。
2つめは、感染を伴わずARA自体が無菌性・虚血性の顎骨壊死を引き起こすものである。
MRONJの発症頻度
1.BP製剤
<高用量>
【商品名:ゾメタ点滴静注、ゾレドロン酸点滴静注、パミドロン酸二Na点滴静注用】
日本における調査では、高用量で投与された患者の1.6~32.1%にBRONJが発症している。
また、2016年~2020年に呉市で行われた調査では、高用量BRONJの1年間の発症率は、10万人あたり1,609.2人と報告されている。
<低用量>
【商品名:リクラスト点滴静注液、フォサマック錠、ボナロン(点滴静注・錠・ゼリー)、アレンドロン酸(点滴静注・錠)、ボンビバ(静注・錠)、ボノテオ錠、リカルボン錠、ミノドロン酸錠、アクトネル錠、ベネット錠、リセドロン酸Na 錠、ダイドロネル錠】
低用量投与は各経口薬とゾレドロン酸やイバンドロン酸などの注射薬で骨粗鬆症に用いる場合が大部分であるが、癌治療関連骨減少症(cancer treatment induced bone loss;CTIBL)に対し、骨粗鬆症の診断後にBP製剤が使用される場合も該当する。
日本のレセプトデータを基に行われた調査ではARA を投与された骨粗鬆症患者のMRONJの発症率は22.9/10万人年と報告されている。
日本の人口の1/20を占める兵庫県で行われた2018年から2020年の3 年間のMRONJ 調査では、約1,000例のMRONJ が報告された。MRONJの53.9%が低用量ARAによるものであり、そのうち85.5%がBRONJ、14.5%がDRONJであることが報告されている。
日本口腔外科学会の疾患調査での同期間中の日本全体のMRONJの報告数が約2万例であったことから、兵庫県での調査が日本の現状を反映しているものと考えると、わが国では低用量でのBRONJの新規発症が年間約2,500例はあると推算される。
また、呉市の調査では、ARA未使用の患者におけるONJの一年間の発症率は10万人あたり5.1人であったのに対し、低用量BP使用患者では10万人あたり135.5人であることが報告されている。
2.Dmab製剤
<高用量>
【商品名:ランマーク皮下注】
高用量での投与には、多発性骨髄腫による骨病変、固形癌骨転移による骨病変および骨巨細胞腫への使用が該当する。いくつかの臨床試験やメタアナリシスによると、Dmab製剤を投与されたがん患者において1.7~1.8%にDRONJが発症すると報告されている。観察研究ではDmab製剤を投与されたがん患者の5.7~33.3%でMRONJの発症が報告されている。日本では、年発症率は10万人あたり3,084.8人との報告がある。
<低用量>
【商品名:プラリア皮下注】
低用量での投与には、骨粗鬆症への使用あるいは関節リウマチに伴う骨びらんの進行抑制を目的とした使用が該当する。ECTSでは、骨粗鬆症患者におけるDRONJの発症率はBRONJと同様にがん患者よりかなり低く、危険因子もBP製剤と同一であるとの見解を示している。
日本では、第Ⅲ相臨床試験で0.2%、コホート研究では0.133%のDRONJの発症が報告されており、呉市の調査では、1年間の発症率は10万人あたり124.7人と報告されている。関節リウマチに対して、日本では60mgを6か月間隔で投与する用法の他に、効果不十分の場合は60mgを3か月間隔で投与する用法も承認されている。

骨吸収抑制薬の投与期間・投与間隔等について
がん患者におけるMRONJの発症率と投与期間との関係について、コホート研究ではゾレドロン酸2年間の治療でBRONJを発症した患者は1.6%~4%であったのに対し、2年より長期の治療で3.8%~18%であったことが報告されている。
従来、がんの骨転移症例に対してはゾレドロン酸もしくはDmab製剤を治療初期より高用量短期間隔(4週間隔)で投与することが推奨されていた。しかし、継続により顎骨壊死だけでなく、非定型大腿骨骨折の危険性が増大するとの懸念から、投与間隔を空け長期間隔(12週毎など)投与にすることとなっている。
BP製剤からDmab製剤への切り替えに関しては、ゾレドロン酸からDmab製剤への切り替えによるMRONJ発症のリスクは変わらないとの報告がある一方、最近では、切り替えはMRONJ発症の危険因子となることが報告されている。
骨吸収抑制薬の予防的休薬の是非
ARA投与中の患者において、抜歯等の歯槽骨に対する歯科口腔外科手術の際にARAを休薬するか否かに関しては、質の高いエビデンスは得られていないことから、いまだ議論の的である。
本委員会でのシステマティックレビューの結果、抜歯に際しての休薬の利益(MRONJ発症率の低下)を検討した論文はいくつかあったが、いずれも利益を示唆する結果は得られていなかった。反面、抜歯等に際しての短期間の休薬(例:術前2か月程度〜術後)の害(骨粗鬆症関連骨折の発症率の増加、生存率の低下、SREの増加)を検討した論文は見られず害は不明であった。
現状においては休薬の有用性を示すエビデンスはないことから、委員会として「原則として抜歯時にARA を休薬しないことを提案する」とした。
1. 薬剤別の考慮事項
・低用量BP製剤
長期にわたるBP製剤投与により、非定型大腿骨骨折の発生リスクが上昇することが知られており、BP投与が3〜5年に至った時点で脆弱性骨折のリスクを評価した上で、BP製剤を休薬したり、他の薬剤に変更することが可能であると提案されている。
BP製剤の長期投与により顎骨壊死のリスクも増加することが示されているが、その発症率は低く、長期投与例でも抜歯時の休薬による利益は示されていない。
・低用量Dmab製剤
臨床試験のデータでは、Dmab製剤投与中止後に骨密度(BMD)が急速に減少し、骨代謝マーカーが急激に上昇することが示されており、Dmab製剤中止または長期延期後に椎骨骨折が増加する可能性が示されている。これらからDmab製剤は中止しないことが望ましいと考えられている。
Dmab製剤投与後の血中濃度の推移、および抜歯後の骨の治癒過程を考えると、最終投与4か月頃に抜歯を行うことが骨の治療の面で良い結果が得られる可能性がある。歯科インプラントなどの予定手術では参考にされたい。
2. 投与中の歯科治療
1)低用量ARA
抜歯を行う際の休薬がMRONJ発症の予防に有効であるとする十分なエビデンスが現時点では得られていない。
低用量ARAでは、医師と歯科医師の間で歯科治療の必要性を共有しつつ、休薬を前提としない侵襲的歯科治療を含む全ての治療の継続が望まれる。ARA投与中の抜歯後には治癒が遷延する場合があるため、上皮化が十分完了したことを確認すべきである。
抜歯以外の侵襲的歯科治療については、十分なエビデンスの蓄積がなく不明な点が多いものの、歯科インプラント埋入手術については近年多数の報告がある。ARA投与中の歯科インプラント埋入手術について、PP2016ではMRONJ発症のリスク因子とされ、どちらかといえば否定的であった。しかし近年、歯科インプラント埋入手術はリスク因子に寄与しないとする報告や、BP製剤投与中であってもオッセオインテグレーションは得られ、インプラント喪失のリスクは少なかったとの報告がある。これらの知見から、現時点では低用量ARA投与中の患者にインプラント埋入手術を行ってはならないとする根拠はない。
2) 高用量ARA
がんの骨転移などで高用量ARAを投与中の患者は、慎重に抜歯の適否を判断し、まずは他に回避できる治療法があるか検討する必要がある。
しかし近年、がん骨転移の治療を受けている患者の抜歯がMRONJ発症のリスク因子であるとする一方で、根尖病変、重度歯周病、顎骨骨髄炎など顎骨に明らかな感染源が存在する場合は、それ自体がMRONJ発症リスクを引き上げているため抜歯を前向きに検討すべきであるという報告がある。
歯科インプラント埋入手術については、他の代替治療が存在することから高用量ARA 投与中の患者には行うべきではない。
3. 投与中の周術期管理
ARA投与中の患者に対しては、医師と歯科医師が適切に連携を図り、歯科治療を継続することが重要である。
前立腺がんの骨転移患者253例の患者に対する前向き研究で、ゾレドロン酸投与中に3か月毎の歯科的介入を行った群と比較して、行わなかった群ではBRONJ の発症リスクは2.59 倍高い結果であった報告している。口腔管理を中心とした継続的な歯科治療は、良好な口腔衛生状態を維持することができMRONJ発症予防に重要である。
MRONJ 発症予防に特化した抗菌薬の使用については、現在まで基準となる報告はみられず、抗菌薬の種類、投与方法、投与期間についての明確な指標はない。
基本治療方針と治療戦略
MRONJは難治性の疾患と考えられていたため、PP 2016ではMRONJ治療のゴールは「治癒」ではなく、1)骨壊死領域の進展を抑える、2)疼痛、排膿、知覚異常などの症状の緩和と感染制御により患者のQOLを維持する、3)歯科医療従事者による患者教育および経過観察を定期的に行い口腔管理を徹底する、以上の3点が治療の基本方針として挙げられていた。
しかし近年、MRONJの多くは治癒可能な疾患であることが明らかとなってきたことから、基本的に骨露出も含めたすべての症状の消失、すなわち疾患の「治癒」をMRONJ治療の目標とすることが望ましい。

1.治療戦略
PP 2016では、ステージ1は保存的治療、ステージ2はまず保存的治療を施行し、難治例に対して複数の抗菌薬療法、長期抗菌薬療法、静注抗菌薬療法、外科的治療を考慮、ステージ3は外科的治療が主な治療法として記載された。
MRONJの治療法について検討した2010年以降の論文のうち、100例以上を対象とした文献を検索すると、多くの論文ではステージ2、3に対する外科的治療の有効性が報告されている。
委員会ではステージ1では保存的治療と外科的治療の両者を、ステージ2および3では外科的治療を推奨するが、患者の希望や全身状態等を考慮して決定することが必要と考えられる。
2.高用量・低用量で治療の取り扱いを変えるか
基本的には高用量(がん患者)・低用量(骨粗鬆症患者)で治療法を変える必要はない。
骨粗鬆症においては、近年多くの治療薬が開発され、ARAの休薬、変更の余地があるのに対し、がんでは原疾患の状態によっては休薬は困難で代替薬も開発されていないことも治療方針の選択を制限することがある。
3.MRONJ 治療時のARA 休薬は有効か
MRONJ治療時にARAを休薬するべきかどうかについては賛否両論がある。
現時点ではMRONJ治療時のARA休薬を積極的に推奨する根拠はなく、今後の研究結果を待ちたい。
4.保存的治療の目的と方法
保存的治療の治癒率は外科的治療と比べると低いが、とくに骨粗鬆症患者でARAを休薬あるいは他の薬剤に変更可能な場合は、保存的治療で治癒に至ることもある。
保存的治療により腐骨分離を待ってから手術を行う方が良いという見解もあるが、休薬した上で数か月程度保存的治療を行っても腐骨分離は促進されず、直ちに外科的治療を行う場合と比べて治療成績の向上はみられないという報告もある。
本邦で処方できる抗菌性洗口液としては、ポビドンヨード含嗽剤(イソジンガーグル液)、塩化ベンゼトニウム含嗽剤(ネオステリングリーンうがい液)などがある。
抗菌薬療法については効果的な抗菌薬あるいは投与期間について一定の見解はない。アモキシシリン、クラブラン酸/ アモキシシリン、アモキシシリンとメトロニダゾール、シタフロキサキシンなどの抗菌薬を2週~10週投与することにより症状が緩解したとする報告がある。
5.外科的治療の目的と方法
外科的治療の目的は、MRONJを治癒させることである。1回の外科的治療により治癒が得られる場合が多いが、原疾患に対する治療が継続している限り、同部位あるいは別部位に新たにMRONJが発症することもある。
外科的治療の方法としては、1)壊死骨のみを摘出するconservative surgery、2)壊死骨切除に加えて周囲健常骨を一定量削除する、あるいは下顎辺縁切除や区域切除などのextensive surgeryがある。
現在、外科的治療の方法としてはextensive surgeryが推奨される。
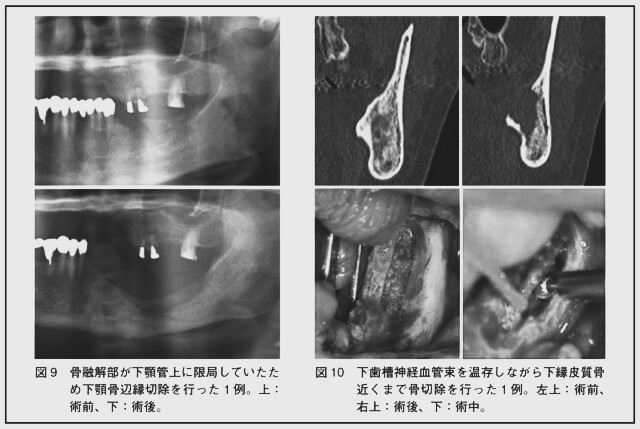
下顎骨発症例で壊死骨が下顎管より上方に限局している場合、下顎骨辺縁切除で良好な予後が期待できる(図9)。壊死骨が下顎管を含む場合は可能なら下歯槽神経血管束を温存しながら辺縁切除(図10)を、残存下顎骨の量が十分でない場合は区域切除を行う。壊死骨が下縁の皮質骨に及ぶ場合は区域切除が施行される。
上顎MRONJに対してもextensive surgeryが推奨される。上顎MRONJでは高頻度で上顎洞炎が併発するが、上顎洞炎に対して壊死骨切除と同時に内視鏡下鼻副鼻腔手術を併用するとする報告や、術中に上顎洞を開洞し洗浄するという報告などがあるが、MRONJに伴う上顎洞炎に対する治療法はいまだ確立していない。
6.補助療法
Conservative surgeryを行い、さまざまな補助療法を追加することにより治療成績を向上させようとする試みがなされている。
血小板由来因子であるPRP、PRGF、L-PRPの併用、オゾン療法、高気圧酸素療法、低出力レーザーなどが有効であるとする報告があるが、その有用性については今後の多数例を用いた報告を待たなければならない。
インプラント治療に関する記載のみ抽出
①MRONJ発症に関わる局所因子
・ 歯周病、根尖病変、顎骨骨髄炎、インプラント周囲炎などの顎骨に発症する感染性疾患
②骨吸収抑制薬の予防的休薬の是非
・低用量Dmab製剤
臨床試験のデータでは、Dmab製剤投与中止後に骨密度(BMD)が急速に減少し、骨代謝マーカーが急激に上昇することが示されており、Dmab製剤中止または長期延期後に椎骨骨折が増加する可能性が示されている。これらからDmab製剤は中止しないことが望ましいと考えられている。
Dmab製剤投与後の血中濃度の推移、および抜歯後の骨の治癒過程を考えると、最終投与4か月頃に抜歯を行うことが骨の治療の面で良い結果が得られる可能性がある。歯科インプラントなどの予定手術では参考にされたい。
③投与中の歯科治療
・低用量ARA
抜歯以外の侵襲的歯科治療については、十分なエビデンスの蓄積がなく不明な点が多いものの、歯科インプラント埋入手術については近年多数の報告がある。
ARA投与中の歯科インプラント埋入手術について、PP2016ではMRONJ発症のリスク因子とされ、どちらかといえば否定的であった。
しかし近年、歯科インプラント埋入手術はリスク因子に寄与しないとする報告や、BP製剤投与中であってもオッセオインテグレーションは得られ、インプラント喪失のリスクは少なかったとの報告がある。これらの知見から、現時点では低用量ARA投与中の患者にインプラント埋入手術を行ってはならないとする根拠はない。
しかし、低用量ARAに加え、他のBMAの投与歴、糖尿病や自己免疫疾患、人工透析中の患者など、MRONJ のリスク因子を有している場合は、決して無理な治療計画を立てるべきでなく、各々の症例についてインプラント以外の代替療法を検討すべきである。
・高用量ARA
歯科インプラント埋入手術については、他の代替治療が存在することから高用量ARA投与中の患者には行うべきではない。
④その他
抜歯および歯科インプラント埋入手術以外の侵襲的歯科治療(歯周外科手術、歯根端切除術、骨隆起の除去など)については、十分なエビデンスがなくMRONJ発症との関連は不明であり、詳細な情報の蓄積によってMRONJの発症予防に有用かの検証が必要である。
医歯薬連携について
1.連携にあたって:処方医から
1)高用量(悪性腫瘍骨転移および多発性骨髄腫)
多くの悪性腫瘍とくに乳癌においては病的骨折により生存率は低下すると報告されている。そのため、乳癌においては骨転移が発見された早期からARAの高用量投与が推奨されている。現在の第一選択はDmab製剤120mg/4週毎であるが、ゾレドロン酸4mg/3-4週毎も適応がある。
高用量投与ではMRONJが発症しやすく、定期的な歯科受診が必要である。また、乳癌に対する併用治療別の検討では、ホルモン療法よりも化学療法の方がMRONJの発生率が高いようである。
2)低用量(CTIBL)
がん患者へのARAの低用量投与には、がん治療中の骨量減少による骨折リスクの減少とがんの転移再発予防である補助療法と二つの目的がある。
がん治療による骨量減少は広くCTIBLとして知られていて、BP製剤とDmab製剤のどちらも効果的に骨量減少を抑制することが証明されてはいるが、骨折リスクの減少が示されているのはDmab製剤の方であり、BP製剤はむしろ補助療法としての有効性が示されている。
3)低用量(骨粗鬆症)
高齢化に伴う骨粗鬆症によって惹起される脆弱性骨折患者数は経年的に増加している。脆弱性骨折、なかでも大腿骨近位部骨折や脊椎椎体骨折は、患者の生活機能や生活の質(QOL)を低下するのみでなく、生命予後悪化をもたらす独立した要因である。
一方でARAによる脆弱性骨折予防効果は高く、相対危険度を50~67%引下げ、脆弱性骨折例を対象とした治療での骨折抑制の治療必要数は32と小さい。
BMAの中でもアレンドロン酸、リセドロン酸、ゾレドロン酸などのBP製剤およびDmab製剤などのARAやこれらによる後治療を前提としたロモソズマブ(骨形成促進薬)を含む逐次療法は、大腿骨近位部骨折抑制作用のエビデンスを有する。
BP製剤およびDmab製剤治療開始時の歯科紹介は極めて重要と考えられ強く推奨される。
テリパラチドは骨リモデリングを活性化することから、MRONJに対してむしろ好ましい作用をもたらす可能性がある。
2.連携にあたって:歯科医から
1)顎骨だけに壊死を生じる理由
顎骨における他の骨と異なる解剖学的特徴として歯の存在が挙げられる。歯は上皮を貫通して顎骨に植立しているため、歯に関連する感染源は、顎骨と歯の間隙、あるいは歯髄が存在する根管を経由して顎骨内に直接到達する。
口腔には800種類以上の常在菌が存在し、歯性感染症のほとんどが常在菌に起因する。近年多くの研究で、ARAを使用している患者の顎骨に細菌感染が暴露することにより、顎骨骨髄炎を経てMRONJが発症すると報告されている。
2)ARA投与時の注意点-歯科的観点から
(1)ARA投与時に必要な歯科治療と医師との情報共有
ARA投与時には感染病変の除去を行っておくことが必要である。一般の口腔衛生管理では口腔細菌数の減少と歯周病の進行の予防を行う。
一方でARAを処方する医師は、投与開始「前」に歯科医師へ紹介を行い、必要な歯科治療を済ませておくことが重要となる。ARA投与前の抜歯後は、概ね2 週間程度で抜歯窩の閉鎖(上皮化)が完了する。これが投与開始時期の1つの目安となる。
(2)歯科治療の実際と治療期間
根尖病変には、活動性と非活動性がある。活動性の場合は、自発痛、咬合時痛、排膿などの自覚症状を伴うため、抜歯の適応となる場合が多い。抜歯適応となる主な疾患は、骨縁下う蝕、重度歯周病、活動性の根尖病変である。根管治療はARAの投与中でも可能である。
また感染が持続することでMRONJ発症リスクを高める可能性もある。基本原則は、できるだけARAによる治療開始時期を延期しないことである。
(3)歯科への患者紹介
処方医はARAを開始するにあたり、MRONJ予防について考慮しなければならない。
原則として骨粗鬆症治療を開始する患者は全例が歯科スクリーニングの対象となる。特に、①1年以上歯科受診歴がない、②かかりつけ歯科医がいない、③咀嚼に何らかの問題を抱えている、④口腔内に何らかの自覚症状がある、などといった場合には症状の詳細や骨粗鬆症治療の必要性や緊急性などについても言及した診療情報提供書を処方医が作成し、歯科へ患者を紹介する。
無歯顎患者の場合も紹介は必要で、不適合な義歯や埋伏歯や残根等が感染源となる可能性があるため、歯科ではパノラマX 線画像を撮り顎骨の精査を行う。
3.医歯薬連携の実際
骨粗鬆症の治療を継続して脆弱性骨折を防止し、同時に、MRONJを予防するためには医師、歯科医師および薬剤師の連携が極めて重要である(図14)。
顎骨壊死について注意喚起されている医薬品の一覧

この記事が少しでも参考になれば幸いです。
【参考文献】
・薬剤関連顎骨壊死の病態と管理:顎骨壊死検討委員会ポジションペーパー2023(顎骨壊死検討委員会編)





コメント